大腸桿菌具有遺傳性狀清晰,易于培養和控制,表達水平高,成本低,周期短等特點,是優先的經濟實惠的蛋白表達系統,K-12系列和B系列菌株是工業規模上常用于生物工程的E.coli細菌株。K-12菌種、所衍生出的DH5α、Top10、JM109等菌株,可用于大量生產質粒DNA并進一步制備細胞基因治療產品和病毒載體類疫苗。源于B系的菌株,如BL21,更適用于高效轉染表達載體和常規蛋白的表達,如:病毒蛋白、重組蛋白疫苗、細胞因子、酶類等產品。湖州申科生物針對這兩種菌株的特點,分別開發了E.coli表達菌HCP殘留檢測試劑盒和E.coli克隆菌堿裂HCP殘留檢測試劑盒。
湖州申科構建 HCP ELISA 檢測全流程平臺,確保試劑盒性能可靠。成都生物制品宿主細胞蛋白(HCP)殘留檢測試劑盒開發要求
對于HCP抗體的純化方法,目前美國藥典1132章節推薦有兩種方式,包括protein A或protein G親和柱層析法和HCP抗原親和柱層析法。兩種方法各有優缺點,均符合監管的要求。在實際使用過程中,這對不同產品可能會導致檢測結果的差異。兩者方法得到的抗體主要區別是HCP抗體有效含量的占比。HCP抗原親和柱層析法顯然占比高,但是也存在某些HCP抗體丟失的情況,這也會導致針對某些樣本的檢測結果比前者偏低,需要企業在實際方法建立時進行充分的評估。HCP抗原親和柱層析法對純化工藝要求更高,為保證抗體批間一致性,需要重點考察HCP抗原柱制備工藝、柱子的使用壽命、再制備的一致性等問題。
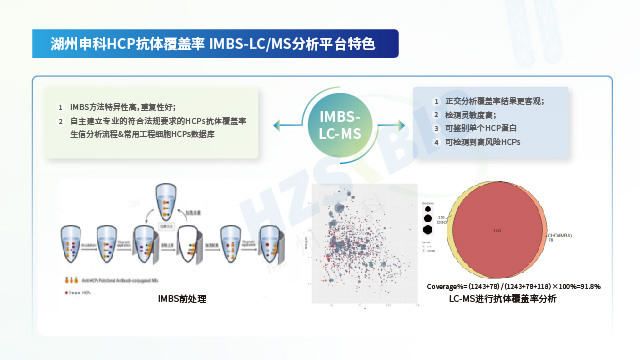
廣東單抗藥物用宿主細胞蛋白(HCP)殘留檢測抗體覆蓋率驗證湖州申科擁有自主搭建的多克隆抗體庫(CHO\E.coli\293T細胞等),提供對應覆蓋率驗證服務。
宿主細胞蛋白(HCP)作為生物制品中來源于細胞基質的殘留雜質,具有明顯的異質性特征。其復雜性體現在三個方面:①理化特性差異:HCP涵蓋胞內及分泌蛋白,涉及關鍵生理功能,具有涵蓋區間大的等電點(pI 3-11)、分子量范圍(5-250kDa)及疏水性;②上游工藝影響:不同發酵工藝(如細胞株、培養條件)誘導獨特的翻譯后修飾(PTM),導致HCP總量與生化復雜性增加;③下游工藝與產物特性干擾:抗體、細胞因子等重組蛋白或病毒類藥物的純化工藝會選擇性殘留特定HCP,且產物形式(如大腸桿菌的包涵體/可溶性表達)直接影響HCP殘留譜。針對特定生產工藝開發定制化檢測方案是準確監控宿主細胞蛋白殘留的關鍵。
為什么定制化試劑盒是宿主細胞蛋白殘留檢測的優先選擇?原因之一是來源特定工藝下抗原及校準品更具代表性。不同生物制品的上游生產工藝,包括培養基,培養條件,收獲時機等差異,均會導致產生的HCPs的蛋白種類、豐度以及蛋白翻譯修飾不同,因此進入到下游純化工藝的HCP類型也隨之發生變化,尤其是與藥物主成分共純化的HCPs會成為優勢蛋白而存在于藥物原液或制劑中。HCP定制化ELISA檢測試劑盒通常選取實際生產工藝中上游發酵后的樣品進行抗原及校準品的制備,所制備的校準品可以較為充分地反映實際生產工藝中的HCP,減少因抗原校準品種類不足導致的漏檢以及定量不準確的風險。
在生物制品質控領域需要基于產品特性與風險分析,聚焦關鍵質控點開發宿主蛋白殘留檢測方法。
影響宿主細胞蛋白(HCP)殘留檢測結果的因素之一是方法選擇。酶聯免疫吸附法(ELISA法)和液相色譜-質譜聯用方法(LC-MS法)是目前HCP檢測的兩大常用方法。文獻統計顯示,目前對于總HCP定量,ELISA仍是主流方法;MS法作為對特定蛋白(例如,高風險蛋白)的鑒定和定量,已成為重要的互補手段。此外檢測過程中使用的試劑和耗材的質量直接影響檢測結果的準確性。低質量的試劑可能導致假陽性或假陰性結果。例如,抗體的特異性和親和力不足,可能導致ELISA檢測中的交叉反應;抗原代表性不強或是抗體覆蓋率低,可能會導致漏檢;稀釋液抗干擾能力弱,可能影響檢測準確性。案例研究表明,采用定制化方法替代原有商業化試劑盒后,抗原代表性和抗體覆蓋率明顯提高,HCP檢測值整體升高。
湖州申科可根據客戶要求,快速定制符合用戶生產工藝的HCP商業化檢測試劑盒,滿足用戶快速替換的檢測需求。浙江疫苗產品用宿主細胞蛋白(HCP)殘留檢測抗體制備
工藝特異型試劑盒針對特定生產流程,準確監控HCP殘留,適配工藝變動。成都生物制品宿主細胞蛋白(HCP)殘留檢測試劑盒開發要求
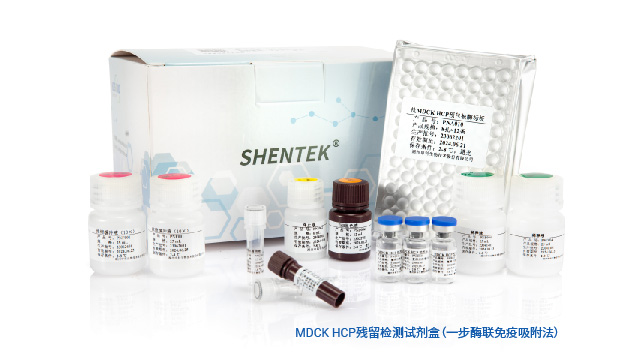
MDCK(Madin-Darby Canine Kidney,馬丁達比犬腎上皮細胞)細胞系是一種來源于犬腎的長久性細胞系,其被普遍用作流感病毒增殖與純化、流感疫苗生產等過程中的細胞基質。基于其易感性、高產高滴度、無適應性突變、易馴化等優勢,MDCK細胞成為公認的適合于流感病毒毒株分離和流感疫苗生產的細胞系。與其他產品雜質一樣,MDCK宿主殘留蛋白(HCP)可能對生物制品的安全性和有效性產生不利影響,因此在生產監測、產品放行等過程中需要對其進行定量研究并進行嚴格控制。SHENTEK® MDCK HCP殘留檢測試劑盒(一步酶聯免疫吸附法)是湖州申科生物自主研發的、具有完全自主知識產權的、實現關鍵試劑全國產化的MDCK HCP通用檢測試劑盒。本試劑盒適用于基于MDCK細胞基質的病毒增殖及純化、疫苗生產等過程中MDCK宿主殘留蛋白的定量檢測。本試劑盒操作步驟少,快速,檢測專一性強,性能穩定可靠。
成都生物制品宿主細胞蛋白(HCP)殘留檢測試劑盒開發要求