湖州申科生物CHO-K1 HCP 殘留檢測試劑盒(一步酶聯免疫吸附法)基于固相酶聯免疫吸附分析法,適用于基于CHO-K1細胞生產的生物制品中宿主殘留蛋白的定量檢測。該分析方法通過在預包被抗CHO-K1HCPs綿羊多抗的酶標板中加入校準品或待測樣品、HRP標記的抗CHO-K1HCPs綿羊多抗進行共孵育。洗滌后,加入TMB底物進行顯色反應,再使用終止液終止酶催化反應。利用酶標儀在450nm波長下測讀吸光度,其吸光度與校準品或待測樣品中的HCPs濃度成正相關,通過校準品擬合的劑量-反應曲線即可計算得出待測樣品中HCPs的濃度。本試劑盒對待測樣品無需進行特殊處理,只需通過合適的稀釋比例進行適用性驗證即可直接使用。本試劑盒操作步驟少,快速,檢測專一性強,性能穩定可靠。
HCP 檢測試劑盒開發要兼顧法規合規、物料充足穩定、團隊專業響應與案例積累,形成系統性保障能力。Hi-5宿主細胞蛋白(HCP)殘留檢測橋接驗證
MDCK(Madin-Darby Canine Kidney,馬丁達比犬腎上皮細胞)細胞系是一種來源于犬腎的長久性細胞系,其被普遍用作流感病毒增殖與純化、流感疫苗生產等過程中的細胞基質。基于其易感性、高產高滴度、無適應性突變、易馴化等優勢,MDCK細胞成為公認的適合于流感病毒毒株分離和流感疫苗生產的細胞系。與其他產品雜質一樣,MDCK宿主殘留蛋白(HCP)可能對生物制品的安全性和有效性產生不利影響,因此在生產監測、產品放行等過程中需要對其進行定量研究并進行嚴格控制。SHENTEK® MDCK HCP殘留檢測試劑盒(一步酶聯免疫吸附法)是湖州申科生物自主研發的、具有完全自主知識產權的、實現關鍵試劑全國產化的MDCK HCP通用檢測試劑盒。本試劑盒適用于基于MDCK細胞基質的病毒增殖及純化、疫苗生產等過程中MDCK宿主殘留蛋白的定量檢測。本試劑盒操作步驟少,快速,檢測專一性強,性能穩定可靠。
浙江工藝特異型宿主細胞蛋白(HCP)殘留檢測免疫策略湖州申科宿主細胞蛋白(HCP)殘留檢測試劑盒校準品凍干保存,穩定性超 10 年,保障長期供應。
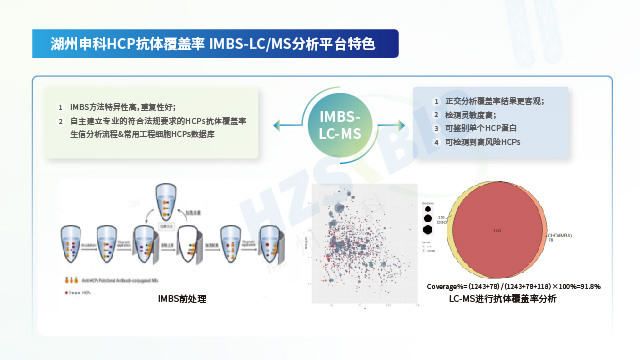
美國藥典USP通則<1132.1> Residual Host Cell Protein Measurement in Biopharmaceuticals by Mass Spectrometry(質譜法測定生物藥中殘留宿主細胞蛋白)主要介紹了LC-MS技術在宿主細胞殘留蛋白檢測中的應用,從樣品制備、質譜測試條件的建立、數據的分析、質譜方法驗證等多個方面,詳細闡述了質譜技術在HCPs中應用的優勢與注意事項。作為一種先進的分析技術平臺,質譜技術在HCPs分析中的應用,以及與ELISA方法和其他分析方法結合使用,有助于生產企業在產品的整個生命周期中更好地理解和建立HCPs的檢測方法,保證產品質量的穩定。
宿主細胞蛋白來源中往往同時存在核酸,胞膜脂類,培養基中的氨基酸等非HCP成分會干擾總蛋白的檢測準確性,需要在檢測之前進行純化前處理,同時對總蛋白檢測方法進行方法學確認。HCP是一種多蛋白質的混合物,總蛋白定量方法之間檢測結果會存在一定程度的差異,這也是導致HCP免疫檢測方法結果差異的原因之一。若HCP蛋白定量方法間檢測結果差異較大,一般同時采用2種以上經過確認的方法檢測,再取均值。總蛋白檢測方法的定量限一般只能達到μg/mL水平,但是HCP檢測試劑盒的產品校準品在ng/mL水平。從HCP高濃度原液稀釋到低濃度產品校準品中存在稀釋誤差,需要對產品校準品進行重新標定賦值。
湖州申科自主研發IMBS抗體覆蓋率檢測法及低豐度HCP富集技術,合作完成多項課題并發表成果。
畢赤酵母(Pichia pastoris)是第二代酵母表達系統中的代表性菌株,是美國FDA認定的GRAS(Generally Recognized As Safe)微生物,具有表達水平高,產物活性好,培養成本低,易擴大為工業化生產等特點。在生物制藥領域,酶制劑、胰島素、表皮生長因子、膠原蛋白等多種生物制劑已經通過畢赤酵母系統進行商業化生產。與其他產品雜質一樣,畢赤酵母宿主殘留蛋白(HCP)可能對生物制品的安全性和有效性產生不利影響,因此在生產監測、產品放行等過程中需要對其進行定量研究并進行嚴格控制。SHENTEK®畢赤酵母HCP殘留檢測試劑盒(一步酶聯免疫吸附法)是湖州申科生物自主研發、具有完全自主知識產權的、實現關鍵試劑全國產化的畢赤酵母HCP通用檢測試劑盒。本試劑盒適用于基于GS115、X33等在內的畢赤酵母菌株生產的生物制品中宿主殘留蛋白的定量檢測,操作步驟少、快速,檢測專一性強,性能穩定可靠。
HCP 定制化開發需構建成熟平臺、技術實力、合規體系、穩定供應、專業團隊及成功案例的全維度支撐體系。江蘇MDCK宿主細胞蛋白(HCP)殘留檢測試劑盒
湖州申科HCP試劑盒開發經抗原表征、抗體制備到體系驗證,全流程符合法規要求。Hi-5宿主細胞蛋白(HCP)殘留檢測橋接驗證
為什么定制化試劑盒是宿主細胞蛋白殘留檢測的優先選擇?原因之一是建立定制化檢測體系,更滿足商業化生產HCP工藝雜質控制要求。在HCP校準品和HCP抗體兩大關鍵試劑組分滿足要求的前提下,定制化方法的建立和優化是基于真實純化中間品和原液樣品進行,通過優化檢測條件,提高對低濃度HCPs的檢測靈敏度,滿足工藝驗證和過程控制要求。在臨床三期,生產工藝需要進行系統驗證,以確保其穩定性和可重復性。定制化HCP ELISA檢測方法能夠更準確地監測生產工藝中HCP的去除效果,為工藝驗證提供有力支持。在過程控制中,通過工藝特異型的HCP ELISA檢測方法,可以實時監測生產過程中的HCP水平,具備更強的生產異常預警能力,及時發現生產風險,確保產品質量的穩定性。
Hi-5宿主細胞蛋白(HCP)殘留檢測橋接驗證