按照美國藥典1132章節的要求,HCPs校準品需滿足代表性要求,即能覆蓋實際工藝產品生產中的HCPs。從HCP免疫檢測方法使用目的和預期風險管理要求考慮,滿足工藝開發和驗證,同時為了應對下游工藝中潛在的異常工藝失效,或工藝變更需求,建議采用上游發酵工藝末端,如澄清處理后工藝點的樣本作為HCPs的來源。在實際制備中,可采用空細胞或空載細胞在模擬實際工藝的預定條件進行采集,通過二維電泳或高分辨率質譜等蛋白質組學方法進行模擬工藝和實際工藝下HCPs的代表性表征分析。越靠近下游HCPs蛋白種類越少,也越接近DS中HCPs,但是其可能無法滿足工藝開發和驗證需求,也無法保證工藝的潛在風險,往往不推薦使用,或只作為上游工藝HCPs免疫檢測法的輔助使用。
湖州申科宿主細胞蛋白殘留檢測試劑盒開發遵循 ISO 13485 體系,滿足法規申報要求。江蘇單抗藥物用宿主細胞蛋白(HCP)殘留檢測方法學驗證
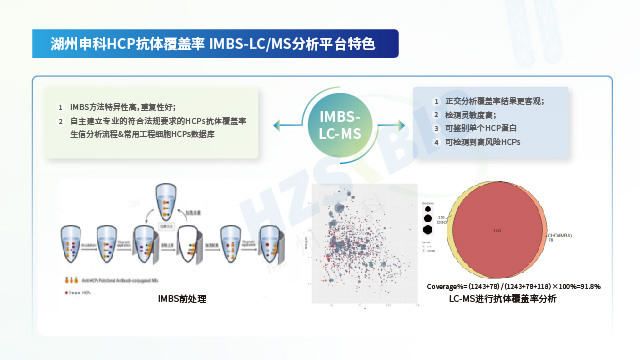
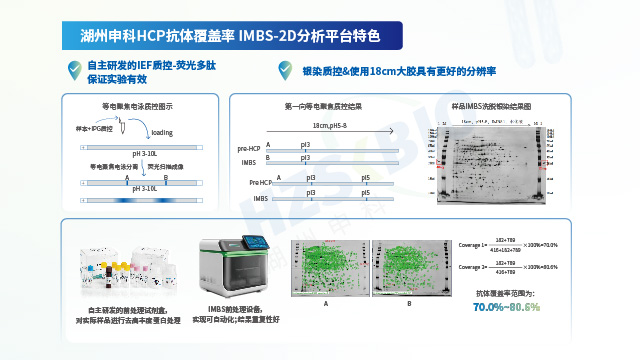
影響宿主細胞蛋白(HCP)殘留檢測結果的因素之一是方法選擇。酶聯免疫吸附法(ELISA法)和液相色譜-質譜聯用方法(LC-MS法)是目前HCP檢測的兩大常用方法。文獻統計顯示,目前對于總HCP定量,ELISA仍是主流方法;MS法作為對特定蛋白(例如,高風險蛋白)的鑒定和定量,已成為重要的互補手段。此外檢測過程中使用的試劑和耗材的質量直接影響檢測結果的準確性。低質量的試劑可能導致假陽性或假陰性結果。例如,抗體的特異性和親和力不足,可能導致ELISA檢測中的交叉反應;抗原代表性不強或是抗體覆蓋率低,可能會導致漏檢;稀釋液抗干擾能力弱,可能影響檢測準確性。案例研究表明,采用定制化方法替代原有商業化試劑盒后,抗原代表性和抗體覆蓋率明顯提高,HCP檢測值整體升高。
成都生物制品宿主細胞蛋白(HCP)殘留檢測抗體覆蓋率驗證工藝特異型試劑盒針對特定生產流程,準確監控HCP殘留,適配工藝變動。
畢赤酵母(Pichia pastoris)是第二代酵母表達系統中的代表性菌株,是美國FDA認定的GRAS(Generally Recognized As Safe)微生物,具有表達水平高,產物活性好,培養成本低,易擴大為工業化生產等特點。在生物制藥領域,酶制劑、胰島素、表皮生長因子、膠原蛋白等多種生物制劑已經通過畢赤酵母系統進行商業化生產。與其他產品雜質一樣,畢赤酵母宿主殘留蛋白(HCP)可能對生物制品的安全性和有效性產生不利影響,因此在生產監測、產品放行等過程中需要對其進行定量研究并進行嚴格控制。SHENTEK®畢赤酵母HCP殘留檢測試劑盒(一步酶聯免疫吸附法)是湖州申科生物自主研發、具有完全自主知識產權的、實現關鍵試劑全國產化的畢赤酵母HCP通用檢測試劑盒。本試劑盒適用于基于GS115、X33等在內的畢赤酵母菌株生產的生物制品中宿主殘留蛋白的定量檢測,操作步驟少、快速,檢測專一性強,性能穩定可靠。
針對宿主細胞蛋白殘留檢測,工藝特異型檢測試劑盒(upstream-process)專為特定生產工藝設計,其關鍵在于使用產物的實際宿主細胞進行開發與驗證,模擬真實生產流程獲取廣譜HCP抗原,并要求抗血清具備高度覆蓋率以適應工藝變動,確保對特定生產流程殘留的高度準確監控。平臺型檢測試劑盒(platform)則由生產商針對其特定表達宿主細胞和相近工藝自行開發,其優勢在于可使用相同的參考標準品和試劑統一監測在該宿主上生產的不同產品,適用于上游工藝足夠相似的產品線。通用型檢測試劑盒(commercial)則作為市售廣譜方案,適用于相似宿主細胞的常規檢測,但因其制備過程可能無法完全模擬目標產物的實際生產,必須嚴格評估多克隆抗體對特定產品HCP的覆蓋率,以保證檢測可靠性。三類試劑盒覆蓋從深度定制到通用篩查的不同需求。
HCP 檢測試劑盒開發要兼顧法規合規、物料充足穩定、團隊專業響應與案例積累,形成系統性保障能力。
SHENTEK®AbunProteoX是一種基于磁珠構建的親和配體,適用于各類生物制品樣本,操作流程經過精心設計,簡化而高效,便于用戶實施。與傳統的非變性酶解方法相比,AbunProteoX能夠顯著提高了HCP的檢出,有效增強了質譜分析的檢測下限,使得低豐度蛋白得以被有效檢出,確保了檢測的高靈敏度。即使在高豐度目標蛋白存在的情況下,經過AbunProteoX處理,仍可有效地分析HCPs,為生物制品中宿主細胞蛋白殘留控制提供了一個簡便、易于使用和有力的樣品處理工具。
總蛋白檢測差異是 HCP 免疫檢測結果不同的原因之一。江蘇單抗藥物用宿主細胞蛋白(HCP)殘留檢測方法學驗證
HCP檢測的經典方法是ELISA法,但該方法在檢測過程中存在漏檢風險,需要對試劑盒抗體進行抗體覆蓋率評估。江蘇單抗藥物用宿主細胞蛋白(HCP)殘留檢測方法學驗證
HEK 293細胞來源于人胚腎細胞,廣泛應用于細胞與基因治療領域,如病毒載體的生產等。盡管生物制品會經過一系列純化工藝以去除相關雜質,但殘留的微量宿主細胞蛋白(HCP)仍會引發機體的免疫應答,影響產品的質量和安全。因此,需要對生產工藝中殘留的HEK 293 HCP進行定量檢測,使其符合放行標準。湖州申科生物HEK 293 HCP殘留檢測試劑盒(一步酶聯免疫吸附法)適用于HEK 293和HEK 293T來源的生物制品(重組蛋白類、細胞和基因治療類等)中宿主細胞蛋白的定量檢測。試劑盒檢測步驟少,快速,專一性強,性能穩定可靠。
江蘇單抗藥物用宿主細胞蛋白(HCP)殘留檢測方法學驗證