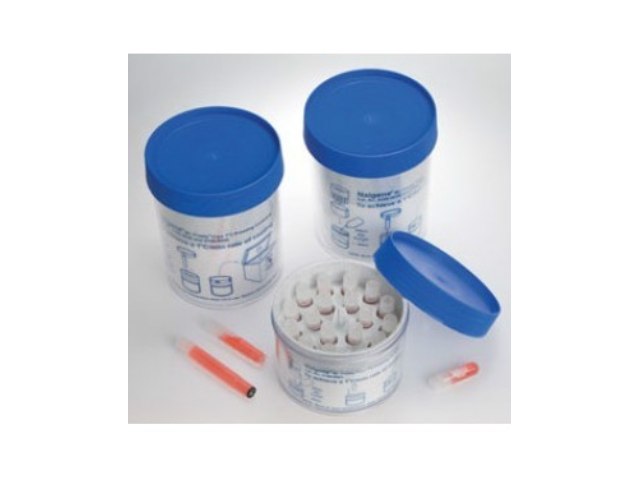
- 產地
- 蘇州
- 品牌
- 無血清細胞凍存液
- 型號
- 齊全
- 是否定制
- 是
無血清細胞凍存液通用于各種動物細胞株(tumour細胞和常規細胞),大部分的干細胞,凍存細胞可在-80℃長期保存。不含動物源性蛋白,不含血清成分,可有效減少各類細菌、病毒和支原體等污染,保證凍存細胞的安全。該凍存液含DMSO、葡萄糖等各種細胞營養成分,提高細胞存活率和活力,亦適合于無血清培養細胞和蛋白表達細胞。產品優勢:1、無需程序性降溫,可直接將細胞置于-80℃凍存,凍存液無需稀釋。2、細胞可于-80℃長期保存。3、凍存液不含血清等,較大降低細胞污染的可能性。保存方法:冰袋運輸,4℃保存,保質期一年。無血清細胞凍存液的優勢:無需程序降溫,可直接放置-80℃凍存,操作簡單。南京正規無血清細胞凍存液廠家現貨

無血清細胞凍存液:凍存注意:開蓋之前,用70%的乙醇或異丙醇擦拭瓶身。以下說明適用于在6孔板內的培養物的凍存。培養物應該在適合傳代的時候進行收集和凍存。每管所含有的細胞應當來源于6孔板的1個培養孔。如果使用其他的培養器皿,請相應的調整體積。1.在室溫(15-25°C)以300xg離心5分鐘。2.輕輕吸走上清液,注意不要擾動細胞團。3.用血清學吸管以1mL的TBD-698重懸細胞。在打散細胞團時,盡量減少細胞聚集體分解。4.用2mL的血清學吸管將1mL的細胞聚集體轉移到標記好的凍存管中。5.用以下方法凍存細胞聚集體:推薦使用緩速降溫方法,每分鐘降低1度,隨后可以在-196°C液氮長期保存。不推薦在-80°C長期保存。逐步降溫法:-20°C保存2個小時,然后-80°C中保存2個小時,隨后可以在-196°C液氮中長期保存。濟南無血清細胞凍存液廠家供應鏡檢后,研究者可根據各自方法和需要來進行細胞培養。

年連續三年成為新賽美全產品線中“受客戶喜歡的科研產品”“無血清細胞凍存液關鍵技術及產業化”項目成功入圍“2017年東吳科技創新創業人才計劃“3優勢分析傳統凍存液CELLSAVING成分“血清+培養基+dmso”四大類,成分明確,不含血清安全性1、微生物污染風險2、批次不穩定1、無微生物污染風險險2、批次穩定操作1、4℃(40min)→20℃(30min)→80℃→液氮2、程序性降溫盒(多人共用;異丙醇)直接凍于-80℃冰箱,長期保存效果活率偏低,批次有差異,不適用無血清細胞凍存90%以上,復蘇后幾乎看不到死細胞
凍存細胞復蘇方法:1.從冰箱里取出細胞冷凍保存管,立即放入37℃振動水浴槽中快速解凍。2.待凍存管中細胞混合液完全融化后,立即加入1ml細胞培養基于該冷凍管中與細胞混合,再將細胞混合液從凍存管中移入含有9ml該細胞培養基的試管中,混合均勻。3.離心收集培養細胞(參考離心條件:1,000~2,000rpm,4℃,3~5min),移去上清液。4.清洗細胞,充分洗凈殘留凍存液。5.加入適量的新鮮細胞培養基,使用移液管緩緩地均勻細胞混合液。適量地稀釋后,將細胞混合液移至事先準備好的培養瓶中。6.鏡檢后,研究者可根據各自方法和需要來進行細胞培養。無血清凍存液使用方法:將凍存管直接轉移至-80C水箱中冷凍保存。

細胞凍存是細胞保存的主要方法之一。利用凍存技術將細胞置于-196℃液氮中低溫保存,可以使細胞暫時脫離生長狀態而將其細胞特性保存起來,這樣在需要的時候再復蘇細胞用于實驗。細胞凍存的原理:細胞凍存及復蘇的基本原則是慢凍快融,實驗證明這樣可以較大限度的保存細胞活力。目前細胞凍存多采用甘油或二甲基亞砜作保護劑,這兩種物質能提高細胞膜對水的通透性,加上緩慢冷凍可使細胞內的水分滲出細胞外,減少細胞內冰晶的形成,從而減少由于冰晶形成造成的細胞損傷。復蘇細胞應采用快速融化的方法,這樣可以保證細胞外結晶在很短的時間內即融化,避免由于緩慢融化使水分滲入細胞內形成胞內再結晶對細胞造成損傷。無血清細胞凍存液,為多種保護劑組合。溫州無血清細胞凍存液廠家現貨
一些保護劑,易于穿透細胞,避免細胞內部水分子形成冰晶損傷細胞。南京正規無血清細胞凍存液廠家現貨
細胞凍存液常見問題:1.從繁衍期到產生高密度的單層細胞之前的塑造體細胞都能夠用以凍存,但較好是為多數成長期體細胞。在凍存前一日較好是換一次細胞培養液;2.將凍存管放進液氮容器或從這當中取下時,要搞好安全防護工作中,以防凍壞;3.凍存和再生較好用新配置的細胞培養液。細胞凍存的基本原理:細胞代謝過程需要各種蛋白酶的參與,而這些蛋白酶在環境溫度低于-70℃時會集體不工作,低溫貯藏的目的是通過較低溫使細胞代謝活動近乎停止。細胞因此進入休眠狀態,使細胞“不會老”,所以可以長期保存。因為凍融過程對所有細胞和組織都是有一定傷害的,因此,需要開發出有效的技術來防止細胞死亡和損傷。南京正規無血清細胞凍存液廠家現貨
無血清細胞凍存液,細胞凍存與復蘇后,平均活細胞回收比例超過80%。與含血清凍存液比較,BI無血清凍存液細胞存活率都有較佳的表,BI無血清細胞凍存液也適用于動物血清培養的細胞凍存。復蘇細胞:1.將細胞凍存管由液態氮中取出,置于37度水浴快速溶解回溫。此時可準備培養基、無菌15ml離心管、培養瓶。2.于生物安全柜內,直接以少量培養基反復沖融,使細胞團塊化凍。3.先在無菌15ml離心管中加入5ml培養基,再將化凍的細胞懸液加入離心管中。以200~300g,3分鐘離心收集細胞。4.倒去上清液,以新鮮培養基重懸細胞,移到培養瓶中培養。5.隔天更換新鮮培養基,并觀察細胞存活狀況。細胞凍存管一定要保證完全密...
- 杭州正規無血清細胞凍存液生產廠家 2025-08-22
- 開封正規無血清細胞凍存液廠家供應 2025-08-22
- 上海正規無血清細胞凍存液哪家便宜 2025-08-22
- 北京無血清細胞凍存液直銷價 2025-08-22
- 北京無血清細胞凍存液廠家現貨 2025-08-22
- 長沙無血清細胞凍存液廠家直銷 2025-08-22
- 南昌正規無血清細胞凍存液哪家便宜 2025-08-21
- 蕪湖正規無血清細胞凍存液報價 2025-08-21
- 金華無血清細胞凍存液廠家批發價 2025-08-21
- 青島無血清細胞凍存液進貨價 2025-08-21
- 濟南無血清細胞凍存液推薦廠家 2025-08-20
- 鄭州無血清細胞凍存液供應商 2025-08-20
- 上海無血清細胞凍存液哪家便宜 2025-08-20
- 南京深圳無血清細胞凍存液 2025-08-20
- 蕪湖昆明無血清細胞凍存液 2025-08-20
- 昆明正規無血清細胞凍存液平均價格 2025-08-20


- 溫州細胞外基質膠 08-26
- 金華正規細胞外基質膠價格 08-26
- 鄭州細胞外基質膠廠家批發價 08-26
- 石家莊正規外泌體提取試劑直銷廠家 08-26
- 青島細胞外基質膠直銷價 08-26
- 開封正規外泌體提取試劑廠家推薦 08-26
- 深圳外泌體提取試劑產品介紹 08-26
- 蘇州細胞外基質膠廠家現貨 08-26
- 貴陽正規細胞外基質膠廠家批發價 08-26
- 南京細胞外基質膠單價 08-26