- 產地
- 蘇州
- 品牌
- 無血清細胞凍存液
- 型號
- 齊全
- 是否定制
- 是
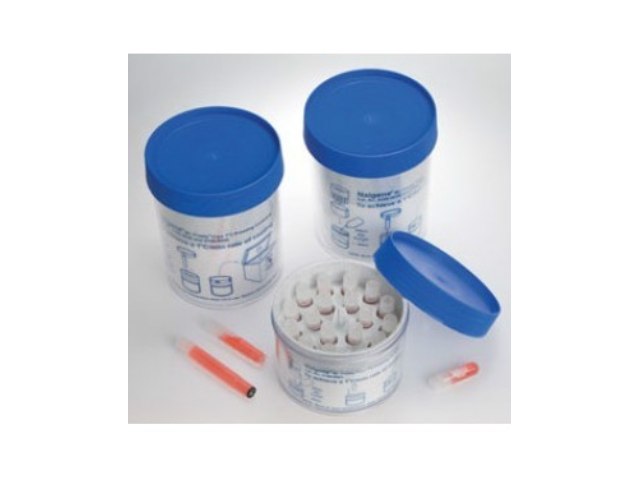
無血清快速細胞凍存液凍存細胞復蘇方法:1、從冰箱里取出細胞冷凍保存管,立即放入37℃振動水浴槽中快速解凍。2、待凍存管中細胞混合液完全融化后,立即加入1ml細胞培養基于該冷凍管中與細胞混合,再將細胞混合液從凍存管中移入含有9ml該細胞培養基的試管中,混合均勻。3、離心收集培養細胞(參考離心條件:1,000~2,000rpm,4℃,3~5min),移去上清液。4、清洗細胞,充分洗凈殘留凍存液。5、加入適量的新鮮細胞培養基,使用移液管緩緩地均勻細胞混合液。適量地稀釋后,將細胞混合液移至事先準備好的培養瓶中。6、鏡檢后,研究者可根據各自方法和需要來進行細胞培養。無血清細胞凍存液,2-8℃保存即可,無需再進行分裝。濟南正規無血清細胞凍存液進貨價

無血清細胞凍存液相對于含血清細胞凍存液的優勢有:1.即用型,無需現配,直接將細胞懸浮于凍存液中即可。2.通用型,適用于凍存各種細胞系、原代細胞。3.無需程序降溫,可直接放置-80℃凍存,操作簡單。4.不含血清,較大減少細胞污染。5.因不含血清,批次間差異小。6.無需液氮,-80℃冰箱長期凍存。7.可培養板整板凍存,例如雜交瘤細胞凍存時可節省篩選過程。無血清細胞凍存液是不含血清和動物源成分,含DMSO、糖類、氨基酸等成分的一款通用型細胞凍存液。正規無血清細胞凍存液服務電話無血清細胞凍存液產品特色:不含動物源成分,病毒、霉菌和支原體等污染可能性低。

細胞凍存是細胞保存的主要方法之一。利用凍存技術將細胞置于-196℃液氮中低溫保存,可以使細胞暫時脫離生長狀態而將其細胞特性保存起來,這樣在需要的時候再復蘇細胞用于實驗。細胞凍存的原理:細胞凍存及復蘇的基本原則是慢凍快融,實驗證明這樣可以較大限度的保存細胞活力。目前細胞凍存多采用甘油或二甲基亞砜作保護劑,這兩種物質能提高細胞膜對水的通透性,加上緩慢冷凍可使細胞內的水分滲出細胞外,減少細胞內冰晶的形成,從而減少由于冰晶形成造成的細胞損傷。復蘇細胞應采用快速融化的方法,這樣可以保證細胞外結晶在很短的時間內即融化,避免由于緩慢融化使水分滲入細胞內形成胞內再結晶對細胞造成損傷。
無血清細胞凍存液:采用patent的凍存配方,用包括重組人血白蛋白等多種蛋白組分替代了血清的用途。用包括DMSO在內的復合凍存保護劑替代了單一的DMSO的保護作用。復合保護劑的內部保護劑,易于穿透細胞膜,避免在細胞凍存過程中細胞內部的水分子形成冰晶損傷細胞;外部保護劑,可在溶液形成冰晶之前,在細胞膜外部競爭性的結合細胞膜表面的水分子,從而降低細胞外溶液的電解質濃度,減少陽離子進入細胞的數量。在細胞內部與外部的協同保護作用下,明顯降低了溫度迅速下降與溫度上升對細胞的損害,因此大幅度提高了細胞經過凍存后的復蘇存活率。無血清細胞凍存液存儲條件:推薦將產品分裝成小管后,再存放于4℃以下或-20℃冰箱凍存。

細胞凍存的基本原理:細胞代謝過程需要各種蛋白酶的參與,而這些蛋白酶在環境溫度低于-70℃時會集體不工作,低溫貯藏的目的是通過較低溫使細胞代謝活動近乎停止。細胞因此進入休眠狀態,使細胞“不會老”,所以可以長期保存。因為凍融過程對所有細胞和組織都是有一定傷害的,因此,需要開發出有效的技術來防止細胞死亡和損傷。低溫保護劑可保護細胞不受細胞內冰凍影響,目前多采用DMSO,甘油,乙二醇和丙二醇等滲透型低溫保護劑。它們的作用機制包括:自由進入細胞,取代水,使冰點下降,充當鹽的二次溶劑,提高細胞膜對水的通透性。無血清細胞凍存液的優勢:無血清細胞凍存液是不含血清和動物源成分。濟南正規無血清細胞凍存液進貨價
無血清凍存液注意事項:若需長期凍存細胞,請轉移至液氮罐中貯存。濟南正規無血清細胞凍存液進貨價
冷凍速率:冷凍速率是指降溫的速度,直接關系到冷凍效果。冷凍速度不同,細胞內水分向外流動的情況也不相同,不同的冷凍速度既然能使細胞內發生不同的生理變化,也可以對細胞產生不同的損傷。超快速玻璃化冷凍對細胞存活來說是較為理想的冷凍方法。細胞內外呈玻璃化凝固,無冰晶形成或形成很小的冰晶,對細胞膜和細胞器不致造成損傷,細胞也不會在高濃度的溶質中長時間暴露而受損。不同細胞的較適冷凍速率不同。小鼠骨髓干細胞、酵母、人紅細胞的較適冷凍速率分別為1.6℃/min、7℃/min和200℃/min。細胞與細胞之間的較適冷凍速率可在1.6℃~300℃/min,故對一種細胞進行冷凍保存之前,首先需要測定其較適冷凍速率,以保證獲得較高的冷凍存活率。濟南正規無血清細胞凍存液進貨價
無血清細胞凍存液,細胞凍存與復蘇后,平均活細胞回收比例超過80%。與含血清凍存液比較,BI無血清凍存液細胞存活率都有較佳的表,BI無血清細胞凍存液也適用于動物血清培養的細胞凍存。復蘇細胞:1.將細胞凍存管由液態氮中取出,置于37度水浴快速溶解回溫。此時可準備培養基、無菌15ml離心管、培養瓶。2.于生物安全柜內,直接以少量培養基反復沖融,使細胞團塊化凍。3.先在無菌15ml離心管中加入5ml培養基,再將化凍的細胞懸液加入離心管中。以200~300g,3分鐘離心收集細胞。4.倒去上清液,以新鮮培養基重懸細胞,移到培養瓶中培養。5.隔天更換新鮮培養基,并觀察細胞存活狀況。細胞凍存管一定要保證完全密...
- 杭州正規無血清細胞凍存液生產廠家 2025-08-22
- 開封正規無血清細胞凍存液廠家供應 2025-08-22
- 上海正規無血清細胞凍存液哪家便宜 2025-08-22
- 北京無血清細胞凍存液直銷價 2025-08-22
- 北京無血清細胞凍存液廠家現貨 2025-08-22
- 長沙無血清細胞凍存液廠家直銷 2025-08-22
- 南昌正規無血清細胞凍存液哪家便宜 2025-08-21
- 蕪湖正規無血清細胞凍存液報價 2025-08-21
- 金華無血清細胞凍存液廠家批發價 2025-08-21
- 青島無血清細胞凍存液進貨價 2025-08-21
- 濟南無血清細胞凍存液推薦廠家 2025-08-20
- 鄭州無血清細胞凍存液供應商 2025-08-20
- 上海無血清細胞凍存液哪家便宜 2025-08-20
- 南京深圳無血清細胞凍存液 2025-08-20
- 蕪湖昆明無血清細胞凍存液 2025-08-20
- 昆明正規無血清細胞凍存液平均價格 2025-08-20


- 開封正規外泌體提取試劑廠家推薦 08-26
- 貴陽正規細胞外基質膠廠家批發價 08-26
- 北京正規細胞外基質膠直銷廠家 08-26
- 重慶正規外泌體提取試劑廠家現貨 08-26
- 細胞外基質膠廠家推薦 08-25
- 細胞外基質膠銷售廠家 08-25
- 杭州外泌體提取試劑報價 08-25
- 長沙正規細胞外基質膠廠家供應 08-25
- 廣州外泌體提取試劑哪里買 08-25
- 昆明正規外泌體提取試劑生產廠家 08-25