- 產地
- 蘇州
- 品牌
- 無血清細胞凍存液
- 型號
- 齊全
- 是否定制
- 是
細胞凍存和復蘇的原則是:慢凍速融,這樣更加有利于保持細胞的活力。凍存細胞不加任何保護劑,會導致細胞內冰晶的產生,從而使細胞產生內源性的機械損傷,引起細胞內環境滲透壓,PH,電解質等的改變,進而促使細胞死亡。在過去的幾十年中,科研工作者將培養基、血清和DMSO按照一定的比例配制成凍存液,并配合手工使細胞從4℃,-20℃,-80℃到液氮中逐步轉移使其達到“慢凍”的效果。但這種自制的凍存液儲存時間一般比較短,不能滿足時間跨度大的實驗項目的需求。且這樣人力和時間成本大,人手操作的誤差和血清制品的批間差也給實驗結果帶來了不穩定性。待凍存管中細胞混合液完全融化后,立即加入1 ml細胞培養基于該冷凍管中與細胞混合。鄭州正規無血清細胞凍存液直銷廠家

細胞凍存和復蘇操作步驟:細胞凍存和復蘇采取“慢凍快融”的原則,慢速冷凍可使細胞內的水份滲出細胞外,減少細胞內形成冰晶的機會,快融以保證細胞外結晶快速融化,避免慢速融化水份滲入細胞內,再次形成胞內冰晶造成對細胞的損傷。細胞凍存及復蘇的基本原則是慢凍快融,實驗證明這樣可以比較大限度的保存細胞活力。目前細胞凍存多采用甘油或二甲基亞砜作保護劑,這兩種物質能提高細胞膜對水的通透性,加上緩慢冷凍可使細胞內的水分滲出細胞外,減少細胞內冰晶的形成,從而減少由于冰晶形成造成的細胞損傷。復蘇細胞應采用快速融化的方法,這樣可以保證細胞外結晶在很短的時間內即融化,避免由于緩慢融化使水分滲入細胞內形成胞內再結晶對細胞造成損傷。鄭州正規無血清細胞凍存液直銷廠家細胞存儲中對細胞凍存更有特殊要求。

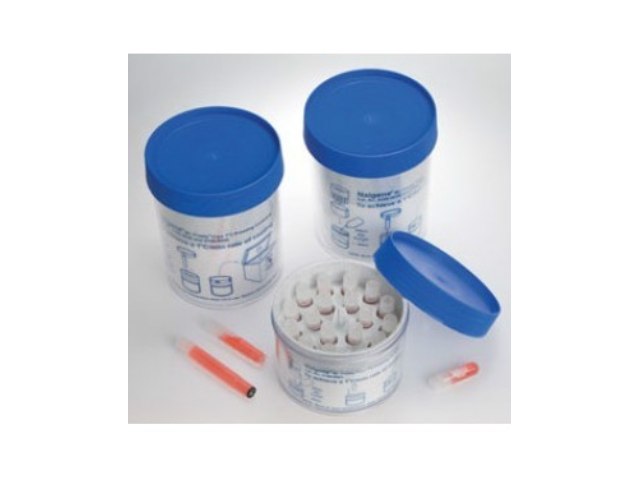
細胞凍存的操作步驟:1.配制含10%DMSO或甘油、10~20%小牛血清的凍存培養液;2.取對數生長期的細胞,去除舊培養液,用PBS清洗。3.去除PBS,加入適量胰蛋白酶(覆蓋培養皿表面)把單層生長的細胞消化下來;4.離心1000rpm,5min;5.去除胰蛋白酶,加入適量配制好的凍存培養液,用吸管輕輕吹打使細胞均勻,計數,調節凍存液中細胞的較終密度為5×106/ml~1×107/ml;6.將細胞分裝入凍存管中,每管1~1.5ml;7.在凍存管上標明細胞的名稱,凍存時間及操作者;8.凍存:標準的凍存程序為降溫速率-1~-2℃/min;當溫度達-25℃以下時,可增至-5℃~-10℃/min;到-100℃時,則可迅速浸入液氮中。也可將裝有細胞的凍存管放入-20℃冰箱2h,然后放入-70℃冰箱中過夜,取出凍存管,移入液氮容器內。
細胞凍存經驗談:選對凍存培養基才是王道:研究人員經常需要冷凍細胞并保存,以供后續實驗或臨床使用。基本過程相當簡單:慢慢冷凍細胞,將凍存管放入液氮中,并在需要時快速解凍。凍存培養基能支持細胞并防止冰晶形成。不過,Malfavon的體驗告訴我們,使用不同的凍存培養基,結果那可是大不同。一些經驗老道的研究人員自己制備凍存培養基。不過,那些面對脆弱細胞(比如原代和多能細胞)的研究人員,則更喜歡購買標準化的商業產品。一些非常敏感的細胞系也許能從添加物中受益,以避免細胞在解凍時凋亡。無血清細胞凍存液產品特色:獨特配方有效提高細胞凍存存活率及復蘇率。

細胞凍存液的原理及配制方法:細胞凍存是細胞培養、引種、保種和保證實驗順利進行的重要技術手段。在細胞建株和建系中,及時凍存原始細胞是十分重要的。在雜交瘤單克隆抗體的制備過程中,雜交瘤細胞、每次克隆化得到的亞克隆細胞的凍存保種常常是必不可少的實驗操作。因為在沒有建立一個穩定的細胞系或穩定分泌抗體的細胞系的時候,細胞的培養過程中隨時可能因細胞的污染、分泌抗體能力的喪失或遺傳變異等等導致實驗失敗,如果沒有原始細胞的凍存,則因為上述的意外而前功盡棄。同時另一些保護劑不能穿透細胞。合肥無血清細胞凍存液服務電話
隨著細胞治好以及細胞儲存產業發展,細胞凍存也面臨從科研應用走向產業轉化。鄭州正規無血清細胞凍存液直銷廠家
細胞凍存:就凍存細胞而言,為了防止細胞在溫度下降時產生胞內細微冰晶,其溫度的下降不能太快。標準的操作是每一分鐘下降一度。有以下三種建議:(1)優先推薦使用程控降溫儀。(2)其次,加有異丙醇的細胞凍存盒,基本上也可以保證每分鐘1℃左右的降溫速度;(3)還有一些普遍的簡易凍存方法。如4℃半小時,-20℃半小時,然后-80℃過夜,再放入液氮;用泡沫盒(裝15mL離心管的那種)加一個保鮮袋,直接放在-80℃凍存;也可以用紗布做成袋子,將細胞懸掛在液氮上方,隔天轉入液氮;在凍存管外面包上棉花,直接放在-80℃冰箱就能夠達到緩慢降溫的效果;有的時候如果確實比較緊急的話,向96孔凍存盒的內部加滿自來水,再將凍存管放置孔中,直接置于-80℃,這樣也能夠達到緩慢降溫的目的。鄭州正規無血清細胞凍存液直銷廠家
無血清細胞凍存液,細胞凍存與復蘇后,平均活細胞回收比例超過80%。與含血清凍存液比較,BI無血清凍存液細胞存活率都有較佳的表,BI無血清細胞凍存液也適用于動物血清培養的細胞凍存。復蘇細胞:1.將細胞凍存管由液態氮中取出,置于37度水浴快速溶解回溫。此時可準備培養基、無菌15ml離心管、培養瓶。2.于生物安全柜內,直接以少量培養基反復沖融,使細胞團塊化凍。3.先在無菌15ml離心管中加入5ml培養基,再將化凍的細胞懸液加入離心管中。以200~300g,3分鐘離心收集細胞。4.倒去上清液,以新鮮培養基重懸細胞,移到培養瓶中培養。5.隔天更換新鮮培養基,并觀察細胞存活狀況。細胞凍存管一定要保證完全密...
- 杭州正規無血清細胞凍存液生產廠家 2025-08-22
- 開封正規無血清細胞凍存液廠家供應 2025-08-22
- 上海正規無血清細胞凍存液哪家便宜 2025-08-22
- 北京無血清細胞凍存液直銷價 2025-08-22
- 北京無血清細胞凍存液廠家現貨 2025-08-22
- 長沙無血清細胞凍存液廠家直銷 2025-08-22
- 南昌正規無血清細胞凍存液哪家便宜 2025-08-21
- 蕪湖正規無血清細胞凍存液報價 2025-08-21
- 金華無血清細胞凍存液廠家批發價 2025-08-21
- 青島無血清細胞凍存液進貨價 2025-08-21
- 濟南無血清細胞凍存液推薦廠家 2025-08-20
- 鄭州無血清細胞凍存液供應商 2025-08-20
- 上海無血清細胞凍存液哪家便宜 2025-08-20
- 南京深圳無血清細胞凍存液 2025-08-20
- 蕪湖昆明無血清細胞凍存液 2025-08-20
- 昆明正規無血清細胞凍存液平均價格 2025-08-20


- 徐州正規外泌體提取試劑廠家推薦 08-27
- 上海正規細胞外基質膠直銷價 08-27
- 寧波細胞外基質膠服務電話 08-27
- 溫州正規細胞外基質膠推薦廠家 08-27
- 深圳細胞外基質膠生產廠家 08-27
- 石家莊外泌體提取試劑報價 08-27
- 金華正規細胞外基質膠哪家好 08-27
- 寧波外泌體提取試劑廠家供應 08-27
- 徐州外泌體提取試劑直銷價 08-27
- 南昌正規外泌體提取試劑直銷價 08-27