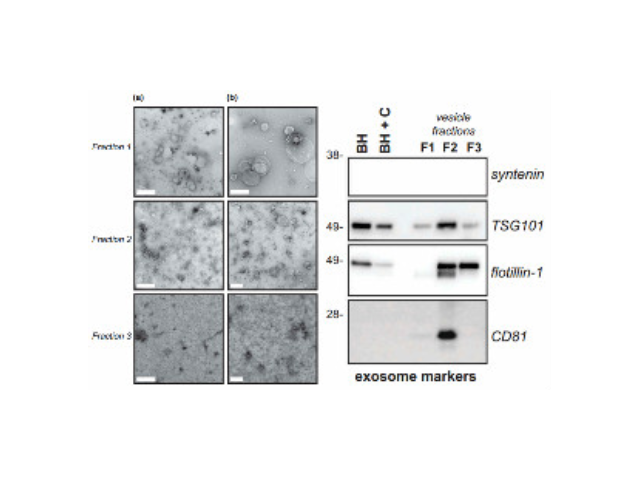
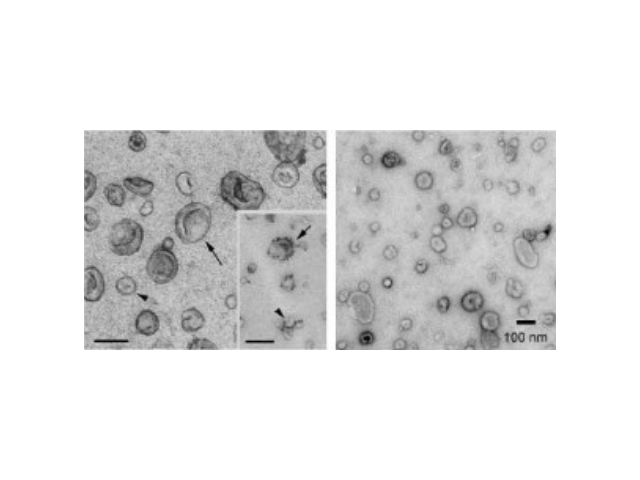
- 產地
- 蘇州
- 品牌
- 外泌體提取試劑
- 型號
- 齊全
- 是否定制
- 是
用于外泌體提取的體液收集注意事項:1、抽血技巧。操作要輕柔迅速。試管可翻轉8-10次使樣本與抗凝劑混勻,避免劇烈搖晃。混勻后,將試管固定垂直放置于離心分離器,在頂部記錄抽血的準確時間,因為抽血與離心之間的時間間隔可能是一個影響因素。外泌體在抽血后30分鐘內是比較穩定的,若時間過長將導致外泌體數量增加。血小板極易因抽血時的物理因素而并釋放出外泌體,其中包括接觸、壓力、切力。2、抽血時間。除了血液黏度,體內血液的各項指標在1天中變化很大。生理節律會對血小板的產生很大的影響。白細胞的募集和循環系統中促炎細胞和細胞會隨時間變化。大量的具有特殊表面分子的微粒也被證明會隨時間變化。目前尚無設計較好的實驗對證實不同時間血液中外泌體的變化,故應在相同的時間采集樣本。目前飲食是否會對EV產生影響尚未可知,但是由于脂蛋白可運載RNA且食物的攝取可以影響循環脂蛋白顆粒的類型、數量和作用,故抽血可在較后一次用餐后一段確定的時間進行。在超速離心力作用下,使蔗糖溶液形成從低到高連續分布的密度階層,是一種區帶分離法。開封外泌體提取試劑直銷價

外泌體的提取方法:1、磁珠免疫法。外泌體表面有其特異性標記物(如CD63、CD9蛋白),用包被抗標記物抗體的磁珠與外泌體囊泡孵育后結合,即可將外泌體吸附并分離出來。磁珠法具有特異性高、操作簡便、不影響外泌體形態完整等優點,但是效率低,外泌體生物活性易受pH和鹽濃度影響,不利于下游實驗,難以普遍普及。2、多聚物沉淀法。聚乙二醇(PEG)為常用的多聚物,可與疏水性蛋白和脂質分子結合共沉淀,早先應用于從血清等樣本中收集病毒,現在也被用來沉淀外泌體,其原理可能與競爭性結合游離水分子有關。利用PEG沉淀外泌體存在不少問題:比如純度和回收率低,雜蛋白較多(假陽性),顆粒大小不均一,產生難以去除的聚合物,機械力或者吐溫-20等化學添加物將會破壞外泌體等鄭州外泌體提取試劑單價外泌體作為內源性的天然藥物載體有著獨特的優勢,表面由脂質和蛋白質組成。
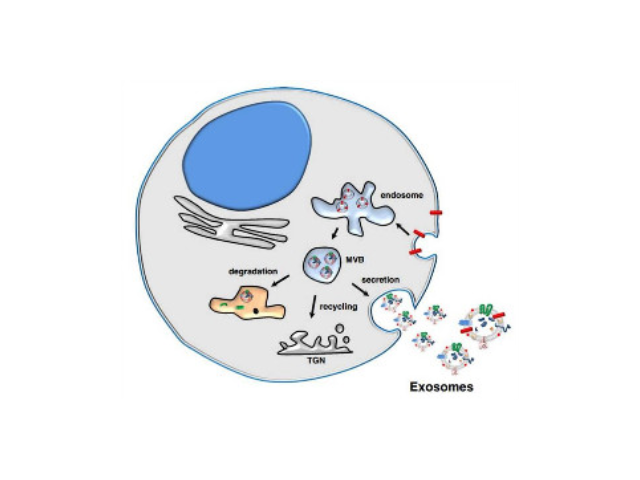
由歐洲多國細胞外囊泡領域的學者發起并成立的國際細胞外囊泡協會(ISEV)于2014年在協會會刊Journal of Extracellular Vesicles發表了一個指導性意見,也就是我們常說的MISEV2014。2018版《指導要求》進行了修訂。2018版的《指導要求》首先討論了對這些細胞來源的非細胞具膜結構如何稱呼。學者們普遍認為應當使用細胞外囊泡(extracellular vesicle)來稱呼這些具膜囊泡,當我們使用常規方法分離這些結構時不推薦使用其他的名稱來稱呼它們。
外泌體與肺病預后:外泌體mirRNA和蛋白質被認為是NSCLC的預后因子。Dejima等在研究NSCLC患者預后的生物標志物時發現,外泌體miR-4257和miR-21的含量顯著上升。此外,還有研究表明,低水平miR-146a-5p的NSCLC患者較高水平miR-146a-5p的NSCLC患者有更高的復發率。Sandfeld-Paulsen等在研究276例NSCLC患者血漿的外泌體時發現,NY-ESO-1是其中對低生存率有顯著影響的標志物。Silva等利用TaqMan低密度芯片的方法系統分析了28位NSCLC患者體內的365種miRNA,其中let-7f、miR-30e-3p和miR-20b表達均下調,進一步研究發現,let-7f和miR-30e-3p水平可以區分早期和晚期NSCLC患者,高水平let-7f和miR-30e-3p與不良預后密切相關。如何高效地提取外泌體是實現這項新興液體活檢技術臨床常規化應用的關鍵外泌體提取:樣本的粘度與分離的外泌體純度有顯著的相關性。

外泌體(exosomes)是活細胞經過"內吞-融合-外排"等一系列調控過程而形成的膜性囊泡,來源于晚期核內體(也稱為多囊泡體),直徑約為30-150nm,密度在1.13-1.21g/ml,天然存在于血液、唾液、尿液及母乳等體液中,同時外泌體也存在于組織和細胞間隙中。人體中幾乎所有類型的細胞均能產生外泌體,人體中大約有1014個外泌體,大約平均每個細胞產生1000-10000個。外泌體中含有核酸(DNA、miRNA、lncRNA、mRNA、tRF等)、蛋白和脂類,在細胞間物質和信息轉導中發揮重要作用,研究表明其在干細胞、免疫調控、瘤轉移、血管生成以及生物標志物等領域都發揮著不可替代的作用。外泌體的提取方法:超濾離心。開封外泌體提取試劑直銷價
外泌體提純試劑盒的特色與優勢:外泌體被純化并且不含任何其他RNA結合蛋白。開封外泌體提取試劑直銷價
外泌體(exosome)是所有細胞釋放出的細菌大小的顆粒。它們天然地存在于血液中。根據來自美國德州大學MD安德森一些疾病中心的一項新的研究,對外泌體進行基因操縱可能提供一種新的胰腺病治病方法。論文通信作者為德州大學MD安德森一些疾病中心一些疾病生物學系研究員RaghuKalluri博士。在這項新的研究中,經過基因修飾的外泌體(被稱作iExosome)能夠運送特異性地靶向KRAS突變基因的小RNA分子,從而導致胰腺病模式小鼠病情緩解,增加它們的總存活率。這些研究人員采用了一種被稱作RNA干擾(RNAi)的靶向方法:利用這些天然的納米顆粒(即外泌體)運送小干擾RNA(siRNA)或短發夾RNA(shRNA)分子來靶向胰腺病細胞中的KRAS突變基因,從而影響多種胰腺病模型的一些病癥負荷和存活。他們證實外泌體能夠作為一種高效的RNAi載體發揮作用,這是因為這些納米大小的囊泡(即外泌體)輕松地在體內遷移和進入靶細胞(包括病細胞)中。開封外泌體提取試劑直銷價
外泌體相關miRNA與肺病的診斷:miRNAs是一類含有20~25個核苷酸的非編碼小RNA,能夠通過下調或壓制靶mRNAs來調節轉錄水平上的基因表達,目前非編碼RNA被普遍發現存在于NSCLC患者外泌體中,參與一些病癥的形成和演化過程。單個miRNA可能通過壓制性復合物與多個mRNA結合,從而阻滯整個生物通路。因此,外泌體的miRNA具有成為NSCLC標志物的優勢。Chen等在152例肺病患者的研究中初次報道了循環游離miRNA的表達,與75例健康者相比,發現了兩種高表達的miRNA(miR-25和miR-223)。Rabinonowits等對27例肺病患者和9例健康人的血漿外泌體中12個mi...
- 長沙外泌體提取試劑報價 2025-08-26
- 石家莊正規外泌體提取試劑直銷廠家 2025-08-26
- 開封正規外泌體提取試劑廠家推薦 2025-08-26
- 深圳外泌體提取試劑產品介紹 2025-08-26
- 重慶正規外泌體提取試劑廠家現貨 2025-08-26
- 廈門正規外泌體提取試劑直銷價 2025-08-26
- 杭州外泌體提取試劑報價 2025-08-25
- 廣州外泌體提取試劑哪里買 2025-08-25
- 昆明正規外泌體提取試劑生產廠家 2025-08-25
- 南京外泌體提取試劑直銷價 2025-08-25
- 杭州正規外泌體提取試劑廠家供應 2025-08-25
- 貴陽外泌體提取試劑產品介紹 2025-08-24
- 武漢外泌體提取試劑廠家批發價 2025-08-24
- 唐山外泌體提取試劑廠家現貨 2025-08-24
- 合肥正規外泌體提取試劑推薦廠家 2025-08-24
- 貴陽外泌體提取試劑廠家現貨 2025-08-24


- 金華正規細胞外基質膠價格 08-26
- 鄭州細胞外基質膠廠家批發價 08-26
- 石家莊正規外泌體提取試劑直銷廠家 08-26
- 青島細胞外基質膠直銷價 08-26
- 開封正規外泌體提取試劑廠家推薦 08-26
- 貴陽正規細胞外基質膠廠家批發價 08-26
- 南京細胞外基質膠單價 08-26
- 北京正規細胞外基質膠直銷廠家 08-26
- 重慶正規外泌體提取試劑廠家現貨 08-26
- 廈門正規外泌體提取試劑直銷價 08-26