- 產地
- 蘇州
- 品牌
- 外泌體提取試劑
- 型號
- 齊全
- 是否定制
- 是
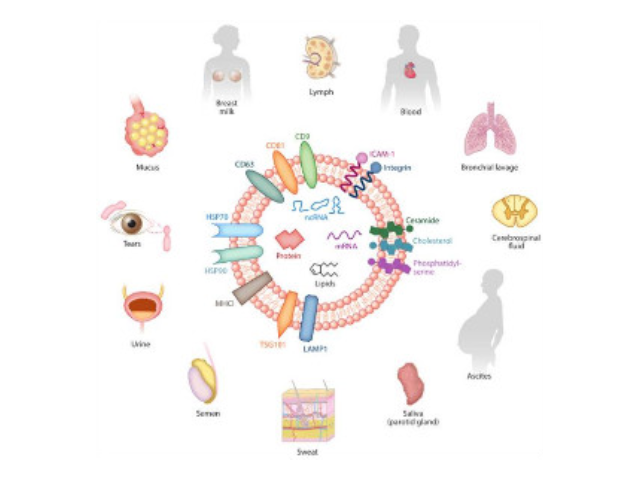
外泌體(Exosomes)是細胞分泌到胞外的一種囊泡(ExtracellularVesicles,EVs),其大小為30-150nm,具有雙層膜結構和茶托狀形態,含有豐富的內含物(包括核酸、蛋白和脂質等),參與細胞間的分子傳遞。外泌體普遍存在于細胞培養上清以及各種體液中,包括血液、唾液、尿液、乳汁等,同時也存在于組織樣本中,如腦組織、肌肉組織、脂肪組織等。腦組織分離方法簡述:將腦組織剪成薄片,放入離心管中加上消化液進行消化,經水浴、反復輕輕上下顛倒,再用移液間斷緩慢吹吸至消化結束。隨后加入培養基于消化液中,混勻,置于冰上。再進行一系列的差速超速離心過程,包括除雜、濾膜過濾、超離等。較后用PBS重懸外泌體,用重懸后的外泌體進行下面的透射電鏡(TEM)、納米粒徑追蹤分子(NTA)和markerWB鑒定。來源于細胞內溶酶體微粒內陷形成的多囊泡體,經多囊泡體外膜與細胞膜融合后釋放到胞外基質中外泌體提取:樣品中大分子不能進入凝膠孔,只能沿多孔凝膠粒子之間的空隙通過色譜柱,被流動相洗脫出來。長沙正規外泌體提取試劑價格
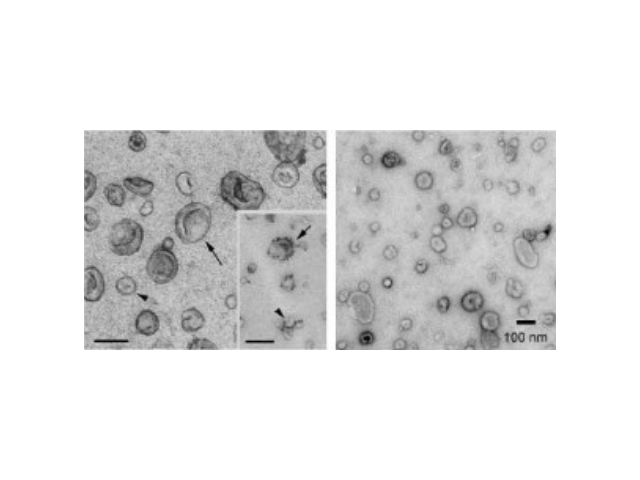
密度梯度離心法該方法由于比較繁瑣,用的較少。原理是:像所有的脂質小囊泡一樣,外泌體可以懸浮于特定密度梯度的蔗糖中,其密度范圍1.13g/ml-1.21g/ml,將要分離外泌體的樣本液體置于梯度蔗糖介質上,隨后通過離心將外泌體分離。此法獲得的外泌體純度較高,但步驟繁瑣,耗時,對離心時間極為敏感。具體步驟是:收集培養2d的上清液。將培養上清液先以1500r/min離心5min除去細胞及碎片,再依次以1000×g離心10min取上清,10000×g離心30min取上清,然后用100ku超濾離心管(Millipore)濃縮至15mL,合肥外泌體提取試劑銷售廠家外泌體提取:免疫分離技術。
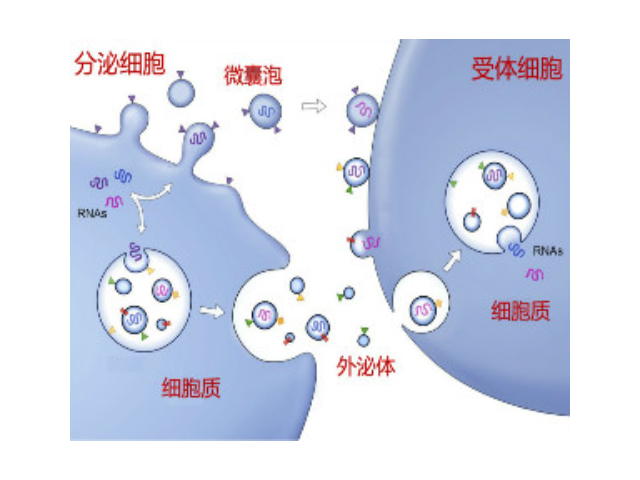
為了分離外泌體,研究人員用兩個這樣的單元串聯構建了一個裝置。首先,使用聲波從血液樣品中除去細胞和血小板。一旦細胞和血小板被去除,樣品進入第二個微流體單元,然后使用較高頻率的聲波將外泌體與稍大的細胞外囊泡分開。這項工作的通訊作者之一,麻省理工學院材料科學與工程系科學家MingDao博士說:“聲波更溫和。而且在分離時,這些囊泡受處理的時間只有1秒鐘或更短。這是一個很大的優勢。”使用該設備,處理100微升未稀釋血液樣本只需要不到25分鐘。“這種新技術可以解決當前外泌體分離技術的缺點,如周期長,一致性差,產量低,污染以及完整性受損等。我們想要把提取高質量的外泌體的過程簡化為按一個按鈕就在10分鐘內獲得所需樣品一樣簡單。”研究人員們說。
外泌體研究思路。外泌體研究通常與高通量測序的聯系緊密,研究思路可以分為三大類:表達譜、分子標志物和分子機制方向,其中表達譜思路的特點就是短平快、通常以測序數據為主要內容,短平快發表3-5分文章。而分子標志物的特點是在表達譜基礎之上加入大量樣本驗證,建立ROC、KM曲線,分析分子與臨床疾病的相關性為主,通常文章影響因子在3-10分之間。分子機制研究,顧名思義要做到細胞功能、機制研究深度,因此工作量通常較大,影響因子通常能夠上10+。唐山正規外泌體提取試劑產品介紹在體內參與細胞通訊、細胞遷移、促血管新生和抗一些病癥免疫等生理過程,與多種疾病的發生和進程密切相關。外泌體的提取方法:密度梯度離心。

外泌體可通過流式、WB(檢測指標有CD9,CD63,CD81)、電鏡觀察、NTA粒徑追蹤等手段檢測,普遍應用于藥物載體、疾病診斷marker、精細醫療、一些病癥治病等方面研究。由于外泌體直徑小,樣本含量低,提取十分困難。已有的外泌體分離方式有密度梯度離心、超濾離心法、免疫磁珠抗體捕獲、商用試劑盒等。但到目前為止,仍沒有一種提取方法能同時保證外泌體的含量、純度以及生物活性。外泌體是細胞間進行物質運輸和信息交流的重要工具,可以通過調節免疫功能促進一些病癥的增殖,血管新生和一些病癥轉移。與細菌傳染,幫助細菌逃避免疫關系很大,并與心血管疾病,老年癡呆等疾病具有密切關系無法實現臨床的常規化應用。長沙正規外泌體提取試劑哪家便宜
外泌體提取:聚乙二醇(PEG)為常用的多聚物,可與疏水性蛋白和脂質分子結合共沉淀。長沙正規外泌體提取試劑價格
外泌體是一種存在于細胞外的多囊泡體,可通過細胞內吞泡膜向內凹陷形成多泡內涵體,內涵體與細胞膜融合后釋放其中的小囊泡。外泌體的直徑在40-110nm之間,其中包含RNA、蛋白質、microRNA等多種物質,存在于血液、唾液、尿液、腦脊液和母乳等多種體液中。外泌體從發現至今已有30多年的歷史,雖然較初被認為可能是細胞的“垃圾”,所以才被排出來,但是近年來研究表明外泌體具有功能活性并可進行細胞間信息傳遞。如今,研究已經發現外泌體在抗原提呈細胞中呈遞抗原程中、一些病癥細胞發生的發展、神經細胞信號轉導過程中都發揮著重要作用。利用化合物沉淀將法外泌體沉淀出來。長沙正規外泌體提取試劑價格
外泌體相關miRNA與肺病的診斷:miRNAs是一類含有20~25個核苷酸的非編碼小RNA,能夠通過下調或壓制靶mRNAs來調節轉錄水平上的基因表達,目前非編碼RNA被普遍發現存在于NSCLC患者外泌體中,參與一些病癥的形成和演化過程。單個miRNA可能通過壓制性復合物與多個mRNA結合,從而阻滯整個生物通路。因此,外泌體的miRNA具有成為NSCLC標志物的優勢。Chen等在152例肺病患者的研究中初次報道了循環游離miRNA的表達,與75例健康者相比,發現了兩種高表達的miRNA(miR-25和miR-223)。Rabinonowits等對27例肺病患者和9例健康人的血漿外泌體中12個mi...
- 蕪湖正規外泌體提取試劑哪里買 2025-08-26
- 長沙外泌體提取試劑報價 2025-08-26
- 石家莊正規外泌體提取試劑直銷廠家 2025-08-26
- 開封正規外泌體提取試劑廠家推薦 2025-08-26
- 深圳外泌體提取試劑產品介紹 2025-08-26
- 重慶正規外泌體提取試劑廠家現貨 2025-08-26
- 廈門正規外泌體提取試劑直銷價 2025-08-26
- 杭州外泌體提取試劑報價 2025-08-25
- 廣州外泌體提取試劑哪里買 2025-08-25
- 昆明正規外泌體提取試劑生產廠家 2025-08-25
- 武漢正規外泌體提取試劑哪家好 2025-08-25
- 杭州正規外泌體提取試劑廠家供應 2025-08-25
- 貴陽外泌體提取試劑產品介紹 2025-08-24
- 武漢外泌體提取試劑廠家批發價 2025-08-24
- 唐山外泌體提取試劑廠家現貨 2025-08-24
- 合肥正規外泌體提取試劑推薦廠家 2025-08-24


- 金華正規細胞外基質膠價格 08-26
- 鄭州細胞外基質膠廠家批發價 08-26
- 石家莊正規外泌體提取試劑直銷廠家 08-26
- 青島細胞外基質膠直銷價 08-26
- 開封正規外泌體提取試劑廠家推薦 08-26
- 深圳外泌體提取試劑產品介紹 08-26
- 蘇州細胞外基質膠廠家現貨 08-26
- 貴陽正規細胞外基質膠廠家批發價 08-26
- 南京細胞外基質膠單價 08-26
- 北京正規細胞外基質膠直銷廠家 08-26